Теллурид бериллия
| Теллурид бериллия | |
|---|---|
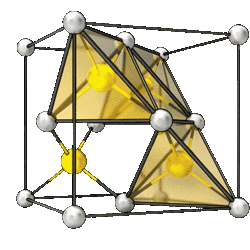 Элементарная ячейка кристаллов типа цинковой обманки. Элементарная ячейка кристаллов типа цинковой обманки.Be Te | |
| Общие | |
| Систематическое наименование |
Теллурид бериллия |
| Традиционные названия | Теллуристый бериллий |
| Хим. формула | BeTe |
| Рац. формула | BeTe |
| Физические свойства | |
| Состояние | твёрдые кристаллы |
| Молярная масса | 136,612 г/моль |
| Плотность | 5,09 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | ~1100 °C |
| Энтальпия | |
| • образования | -30 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | разлагается |
| Структура | |
| Координационная геометрия | тетраэдрическая |
| Кристаллическая структура | кубическая, постоянная решётки 0,5615 нм |
| Классификация | |
| Рег. номер CAS | 12232-27-8 |
| Безопасность | |
| Токсичность | очень ядовит |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Теллури́д бери́ллия — бинарное неорганическое химическое соединение бериллия и теллура с химической формулой BeTe. Бериллиевая соль теллуроводородной кислоты.
Твёрдое бесцветное кристаллическое вещество или мелкокристаллический светло-серый порошок. Кристаллизуется в кубической кристаллической решётке типа цинковой обманки.
По электрофизическим свойствам является широкозонным полупроводником с шириной запрещённой зоны около 2,8 эВ.
Применяется при изготовлении полупроводниковых приборов.
Получение
Теллурид бериллия получают взаимодействием элементарных теллура и бериллия, взятых в стехиометрическом соотношении в атмосфере инертного газа или водорода при температуре около 1100°С[1]:
- [math]\displaystyle{ \mathrm{Be + Te \longrightarrow BeTe} }[/math].
Физические свойства
Тугоплавкое кристаллическое вещество, бесцветные кристаллы. Плотность 5,09 г/см3. Кристаллизуется в кубической сингонии типа цинковой обманки, постоянная решётки кристаллов 0,5615 нм, пространственная группа F43m[2].
Широкозонный полупроводник с шириной запрещённой зоны около 2,8 эВ[3].
Химические свойства
Во влажном воздухе и при контакте с водой теллурид бериллия разлагается с образованием гидроксида бериллия и теллуроводорода, который при комнатной температуре быстро разлагается на элементарные теллур и водород.
Теллурид бериллия практически полностью гидролизуется водой с разложением:
- [math]\displaystyle{ \mathsf{BeTe + 2 H_2O \longrightarrow Be(OH)_2 + H_2Te} }[/math].
Кислоты любой концентрации и силы разлагают теллурид бериллия с выделением теллуроводорода:
- [math]\displaystyle{ \mathsf{BeTe + 2 HCl \longrightarrow BeCl_2 + H_2Te} }[/math],
- [math]\displaystyle{ \mathsf{BeTe + 2 CH_3COOH \longrightarrow Be(CH_3COO)_2 + H_2Te} }[/math].
Теллурид бериллия реагирует с растворами щелочей и карбонатами щелочных металлов с образованием гидроксобериллатов и солей теллуроводородной кислоты щелочного металла:
- [math]\displaystyle{ \mathsf{BeTe + 4 NaOH \longrightarrow Na_2[Be(OH)_4] + Na_2Te} }[/math],
- [math]\displaystyle{ \mathsf{BeTe + 2 Na_2CO_3 + 2 H_2O \longrightarrow Na_2[Be(OH)_4] + Na_2Te + 2 CO_2} }[/math].
Хлор и фтор при взаимодействии с BeТе образуют соответствующие галогениды бериллия, вытесняя теллур:
- [math]\displaystyle{ \mathsf{BeTe + Cl_2 \longrightarrow BeCl_2 + Te} }[/math],
- [math]\displaystyle{ \mathsf{BeTe + F_2 \longrightarrow BeF_2 + Te} }[/math].
Применение
Применяется при производстве полупроводниковых приборов.
Токсичность
Высокотоксичное вещество, во влажном воздухе, при контакте с водой или кислотами выделяется весьма ядовитый теллуроводород и все растворимые соединения бериллия тоже очень ядовиты.
Примечания
- ↑ Georg Brauer, Handbuch der präparativen anorganischen Chemie Band 2, Ferdinand Enke Verlag, Stuttgart, 1978, ISBN 3-432-87813-3, S. 896.
- ↑ Jean D'Ans, Ellen Lax. Taschenbuch für Chemiker und Physiker. — Springer DE, 1997. — 336 с. — ISBN 3-540-60035-3.
- ↑ Stephen J. Pearton. Processing of Wide Band Gap Semiconductors. — William Andrew, 2001. — ISBN 0-81551439-5.
Литература
- Бериллий: Химия и технология редких и рассеянных элементов: Учебное пособие для вузов: Ч. I / Под ред. К. А. Большакова. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1976. Стр. 165—217.
